Chiều 16-4, Bộ Y tế và Viện Vệ sinh Dịch tễ Trung ương đã tổ chức hội thảo truyền thông về việc đưa một số loại vaccine mới vào Chương trình Tiêm chủng mở rộng năm 2018.
Theo GS.TS Đặng Đức Anh, Viện trưởng Viện Vệ sinh dịch tễ Trung ương, 3 loại vaccine mới được đưa vào sử dụng trong Chương trình tiêm chủng mở rộng năm 2018 là vaccine phòng bệnh Sởi – Rubella (MRVAC) do Việt Nam sản xuất, vaccine Bại liệt tiêm (IPV) do Sanofi, Pháp sản xuất và vaccine “5 trong 1” ComBe Five do Ấn Độ sản xuất.
Tất cả 3 loại vaccine này đều đã đạt thẩm định của Tổ chức Y tế Thế giới (WHO) và được cấp phép lưu hành tại Việt Nam.
Trước khi được đưa vào sử dụng trên diện rộng, các loại vaccine mới này đều đã được thử nghiệm tại nhiều địa phương với độ an toàn cao, hiệu quả phòng bệnh đảm bảo yêu cầu đề ra.
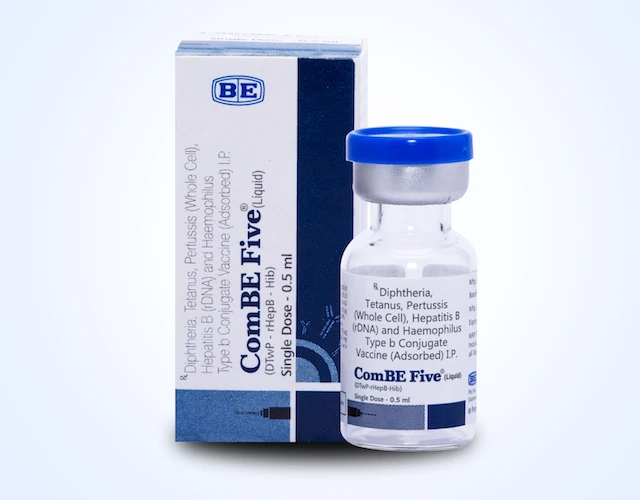 Vaccine ComBe Five sẽ thay thế cho vaccine Quinvaxem
Vaccine ComBe Five sẽ thay thế cho vaccine Quinvaxem Đề cập tới vaccine “5 trong 1” ComBe Five do Ấn Độ sản xuất, PGS.TS Trần Như Dương, Phó Viện trưởng Viện Vệ sinh dịch tễ Trung ương cho biết, loại vaccine ComBe Five sẽ được dùng để thay thế cho vaccine “5 trong 1” Quinvaxem vì hiện nay nhà sản xuất Berna Biotech, Hàn Quốc đã ngừng sản xuất vaccine Quinvaxem.
Vaccine “5 trong 1” ComBe Five có thành phần và tác dụng tương tự như Quinvaxem phòng các bệnh: bạch hầu, ho gà, uốn ván, viêm gan B và viêm phổi/viêm màng não mủ do vi khuẩn Hib.
Vaccine ComBe Five đã đạt các tiêu chuẩn về kiểm định của WHO và được Bộ Y tế cấp phép lưu hành tại Việt Nam từ tháng 5-2017.
Đáng chú ý, trước khi được cấp phép lưu hành tại Việt Nam, vaccine này đã được sử dụng tại hơn 43 quốc gia trên thế giới với trên 400 triệu liều được tiêm bảo đảm an toàn và đây cũng là vaccine được UNICEF cung ứng cho nhiều quốc gia trên thế giới.
PGS.TS Trần Như Dương cũng cho biết thêm, tính an toàn của vaccine ComBe Five tương tự như các vaccine “5 trong1” cùng thành phần. Qua thử nghiệm loại vaccine này tại 4 huyện của tỉnh Hà Nam chỉ ghi nhận một số phản ứng thông thường xuất hiện vào ngày thứ nhất sau tiêm vaccine, bao gồm phản ứng tại chỗ tiêm đau quầng đỏ với tỷ lệ 5-15%, sốt với tỷ lệ 34-39% và không ghi nhận bất kỳ phản ứng nghiêm trọng nào sau tiêm chủng.
Dự kiến việc chuyển đổi sử dụng vaccine ComBe Five thay thế Quinvaxem sẽ được triển khai trên toàn quốc trong tháng 6 và 7-2018.
Trước khi triển khai trên toàn quốc, dự án tiêm chủng mở rộng sẽ triển khai trước tại 4 tỉnh Hà Nam, Bình Định, Kon Tum và Đồng Tháp sau đó mới triển khai tại 11.000 điểm tiểm chủng trong toàn quốc.
Lịch tiêm chủng vaccine ComBe Five cũng giống với vaccine Quinvaxem.
 Bộ Y tế khuyến cáo các gia đình nên đưa trẻ nhỏ đi tiêm chủng đầy đủ và đúng lịch
Bộ Y tế khuyến cáo các gia đình nên đưa trẻ nhỏ đi tiêm chủng đầy đủ và đúng lịch Đối với vaccine vaccine Sởi – Rubella (MRVAC) do Việt Nam sản xuất được dùng thay thế cho vaccine Sởi- Rubella do Ấn Độ sản xuất. Bắt đầu từ tháng 4-2018, vaccine MRVAC đã được sử dụng trên quy mô toàn quốc cho trẻ từ 18 tháng tuổi trong Chương trình Tiêm chủng mở rộng.
Đến nay đã có 19 tỉnh thành trong toàn quốc tổ chức tiêm vaccine MRVAC cho trên 50.000 trẻ từ 18-24 tháng tuổi, với kết quả không ghi nhận bất kỳ trường hợp phản ứng nặng nào sau tiêm.
Đối với vaccine bại liệt tiêm (IPV), Bộ Y tế cho biết, để tiếp tục duy trì thành quả thanh toán bại liệt đạt được, theo khuyến cáo của Tổ chức Y tế Thế giới, cùng với tiếp tục cho trẻ 2,3,4 tháng tuổi uống 3 liều vaccine bại liệt OPV (vaccine bại liệt 2 tuýp) thì cần sử dụng thêm 1 liều vaccine bại liệt tiêm IPV cho trẻ dưới 1 tuổi trong lịch tiêm chủng thường xuyên.
Vaccine bại liệt IPV do hãng Sanofi, Pháp sản xuất và được cấp phép lưu hành ở nước ta. Đây là loại vaccine được Liên minh toàn cầu vaccine và tiêm chủng (GAVI) hỗ trợ và được cung ứng bởi UNICEF.
Nhân dịp này, Bộ Y tế tiếp tục khuyến cáo các bậc cha mẹ tiếp tục đưa con đi tiêm chủng đầy đủ, đúng lịch các vaccine trong Chương trình tiêm chủng mở rộng để phòng các bệnh truyền nhiễm nguy hiểm.