Ngày 31-3, Bộ Y tế đã có quyết định sửa đổi điều 1 quyết định số 3122/QĐ-BYT ngày 28-6-2021 của Bộ trưởng Bộ Y tế phê duyệt có điều kiện vaccine cho nhu cầu cấp bách trong phòng chống dịch bệnh Covid-19.
Trong quyết định này, Bộ Y tế đã bổ sung liều tiêm 0,25ml đối với vaccine Moderna và bổ sung thêm một số nhà sản xuất, nước sản xuất loại vaccine này, gồm: Rovi Pharma Industrial Services, S.A-Tây Ban Nha; Recipharm Monts-Pháp; Moderna TX, Inc-Mỹ; Catalent Indiana, LLC-Mỹ; Lonza Biologics, Inc-Mỹ; Baxter-Mỹ; Moderna Biotech-Tây Ban Nha; Samsung Biologics Co., Ltd.-Hàn Quốc.
Trong quyết định mới nhất này, Bộ Y tế cũng chỉ rõ vaccine Spikevax (Tên khác là Covid-19 Vaccine Moderna; Moderna Covid-19 Vaccine; Moderna mRNA-1273 Vaccine, Covid-19 mRNA Vaccine (nucleoside modified) là dạng bào chế hỗn dịch tiêm bắp.
Cũng tại quyết định mới nhất này, Bộ Y tế bãi bỏ quyết định số 3122/QĐ-BYT ngày 28-6-2021 của Bộ trưởng Bộ Y tế phê duyệt có điều kiện vaccine cho nhu cầu cấp bách trong phòng chống dịch bệnh Covid-19 và các quyết định sửa đổi Quyết định 3122.
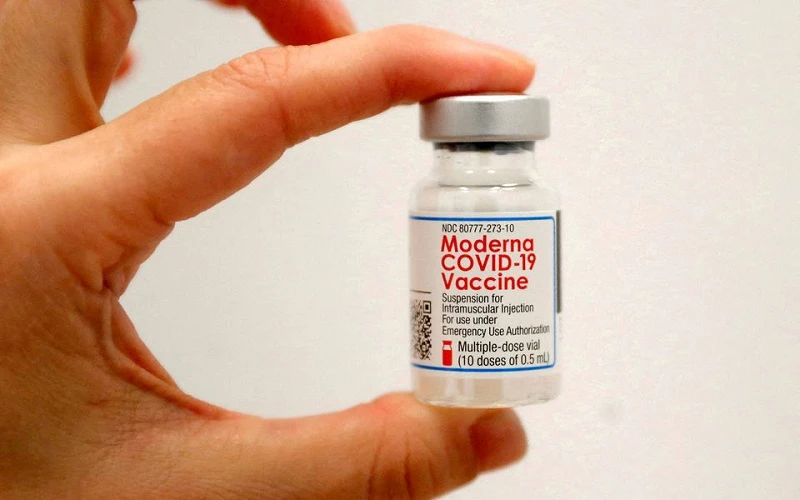 Vaccine Moderna được bổ sung liều tiêm 0,25ml
Vaccine Moderna được bổ sung liều tiêm 0,25ml Đáng chú ý, liên quan đến vaccine Moderna, căn cứ vào kết luận của Hội đồng Tư vấn cấp giấy đăng ký lưu hành thuốc và nguyên liệu làm thuốc, Cục Quản lý Dược đồng ý cập nhật hạn dùng của vaccine này từ 7 tháng lên 9 tháng (kể từ ngày sản xuất) ở điều kiện bảo quản -25 độ C đến -15 độ C đối với các cơ sở sản xuất vaccine này đã được Bộ Y tế phê duyệt cho nhu cầu cấp bách trong phòng, chống dịch Covid-19. Việc cập nhật hạn dùng này được áp dụng đối với các lô vaccine Moderna được nhập khẩu vào Việt Nam kể từ ngày 2-3.
Trước đó, việc cập nhật hạn dùng vaccine Covid- 19 của Moderna cũng đã được Tổ chức Y tế Thế giới (WHO) phê duyệt vào ngày 9-2, Cơ quan Quản lý Dược của châu Âu (EMA) phê duyệt ngày 8-12-2021, Cơ quan Quản lý Dược và Thực phẩm Hoa Kỳ (US FDA) phê duyệt ngày 31-1.